浅谈临床化学定量项目的性能验证
性能验证的时机
检验程序常规应用前
任何严重影响检验程序分析性能的情况发生后,应在检验程序重新启用前对受影响的性能进行验证。影响检验程序分析性能的情况包括但不限于:仪器主要部件故障、仪器搬迁、设施(如纯水系统)和环境的严重失控等。
常规使用期间,实验室可基于检验程序的稳定性,利用日常工作产生的检验和质控数据,定期对检验程序的分析性能进行评审,应能满足检验结果预期用途的要求。现用检验程序的任一要素(仪器、试剂、校准品等)变更,如试剂升级、仪器更新、校准品溯源性改变等,应重新进行验证。
性能验证的参数
临床化学定量检验程序的分析性能参数一般包括:测量正确度、测量精密度(含测量重复性和测量中间精密度)、测量不确定度、分析特异性(含干扰物)、分析灵敏度、检出限和定量限、线性区间(可报告区间)等。
性能验证的判断标准
实验室应根据临床需求制定适宜的检验程序分析性能标准。实验室制定性能标准时宜考虑相关制造商或研发者声明的标准、国家标准、行业标准、地方标准、团体标准、公开发表的临床应用指南和专家共识等。实验室性能验证的结果应满足实验室制定的判断标准。
分析性能验证方案包括:
1、正确度
2、精密度
3、线性
4、生物参考区间
5、临床可报告范围
评价内容一:正确度
实验室可采用偏倚评估、回收试验、与参考方法比对等方式进行正确度的验证。
当实验室无法开展正确度验证时,可通过参加能力验证、比对试验等途径,证明其测量结果与同类实验室结果的一致性。如与 CNAS 认可的 PTP(或可提供靶值溯源性证明材料的 PTP)提供的 PT 项目结果进行比对,或与 CNAS 认可的实验室使用的经性能验证符合要求的在用检测程序进行比对。
验证方案:参照CNAS-GL037《临床化学定量检验程序性能验证指南》进行检测系统可比性性能评价,使用5 份 PT 样本,每个样本重复测定3 次。将检测结果均值与靶值进行比对,计算偏倚,以1/2总允许误差(TEa)作为评价标准,偏倚小于总允许误差(TEa)的1/2,认为新检测系统的偏倚属临床可接受水平。
以雅培 Alinity TT4 项目为例:

评价内容二:精密度
精密度验证应包括重复性和中间精密度
可采用新鲜或冻存的样本。当样本中待测物不稳定或样本不易得到时,也可考虑使用基质与实际待检样本相似的样本,如质控品。应至少评估 2 个水平样本的不精密度。当 2 个水平样本的不精密度有显著差异时,建议增加为 3 个水平。所选样本的被测物水平应在测量区间内,适宜时,至少有 1 个样本的被测物水平在医学决定水平左右。
验证方案:参照CLSI EP15-A 《医学实验室精密度和准确度的确认》进行检测系统精密度性能评价,每天检测 1 个分析批,每批检测 2 个水平的样本(质控),每个样本重复检测5次, 连续检测5天。对数据进行收集,计算批内标准差:= 、批间方差=
、批间方差=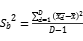 、实验室内标准差=
、实验室内标准差= 、批内标准差(Sr)≤1/4TEa * 总均值, 总的标准差(S1)≤1/3TEa * 总均值,精密度验证通过。
、批内标准差(Sr)≤1/4TEa * 总均值, 总的标准差(S1)≤1/3TEa * 总均值,精密度验证通过。
以雅培 Alinity TT4 项目为例:
浓度水平1
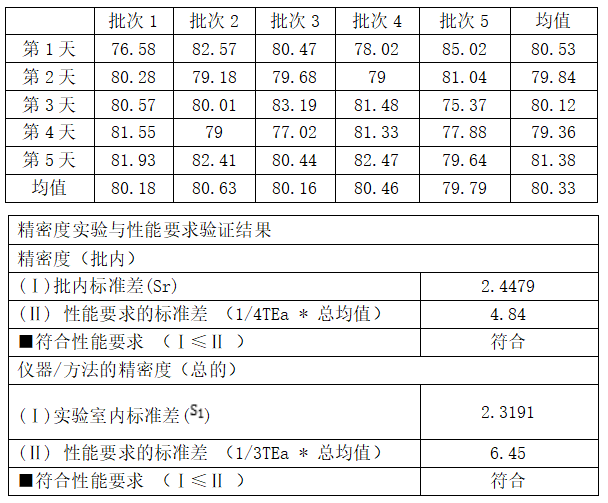
浓度水平2
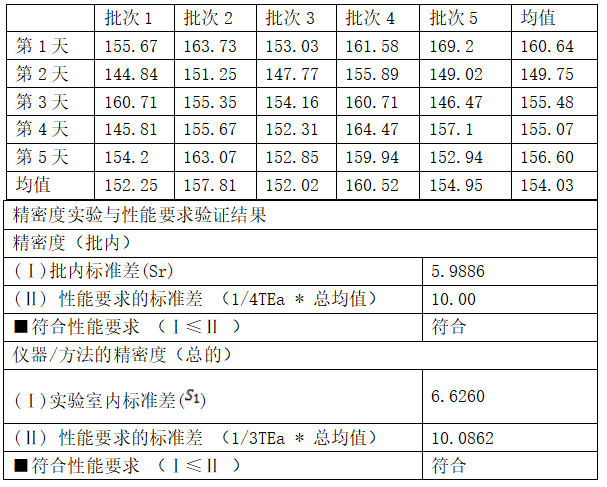
评价内容三:线性
验证样本基质应与待检临床实验样本相似,不可采用含有对测定方法具有明确干扰作用物质的样本,如溶血、脂血、黄疸或含有某些特定药物的样本。在已知线性区间内选择 5~7 个浓度水平,应覆盖定量限(低限和高限)。
方案:参照WS/T 408-2012《临床化学设备线性评价指南》进行检测项目线性评价,将低浓度样本与高浓度样本按如下样本比例精确配成等浓度间隔的5个不同浓度水平样本,所有样本在一次运行中或几次间隔很短的运行中随机测定,在1天内完成检测,每个浓度水平样本重复测定3次。计算每个浓度水平样本检验结果的均值和理论值,所有数据总平均值,对数据组进行回归分析。
以雅培 Alinity TT4 项目为例:
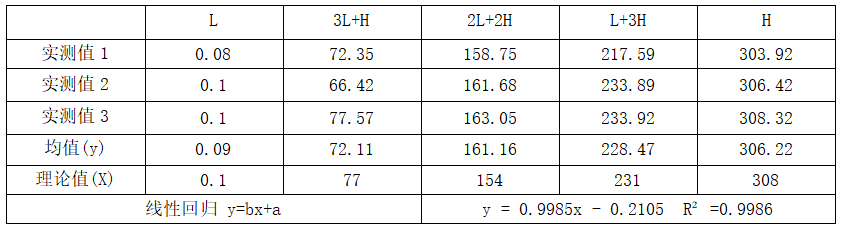
结果判断:R2≥0.95;b值在0.97-1.03的范围内
测试结果:R2 = 0.9986在·
b = 0.9985
结论:该实验方法分析线性符合判断标准
实验室在引用参考区间前应进行必要的验证,验证前实验室应保证分析系统性能符合要求,且室内质控在控,室间质评合格。
评价内容四:生物参考区间
实验室在引用参考区间前应进行必要的验证,验证前实验室应保证分析系统性能符合要求,且室内质控在控,室间质评合格。
参考区间验证可按下列步骤进行:
a) 筛选合格参考个体不少于 20 例,性别、年龄应分布均衡。注:增加验证的参考个体例数,如≥60例,有利于获得更可靠的评估结果。
b) 按本实验室操作程序采集、处理、分析标本,分析前需保证分析系统性能符合要求;
c) 按适当方法检查并剔除离群值(若有离群值,则另选参考个体补足),离群值检验采用 Dixon方法:首先将检测结果按照大小排序并计算极差(最大值与最小值之差)R,然后分别计算最大值和最小值与其相邻数值之差 D;若 D/R≥1/3,则将最大值或最小值视为离群值予以剔除;将其余数据重复前述步骤进行离群值检验,直至剔除所有离群值;
d) 如选择 20 例合格参考个体,将 20 例检验结果与参考区间比较,若在参考区间之外的数据不超过 2 例,则通过验证;若超过 2 例,则另选 20 例合格参考个体重新按照上述判断标准进行验证。如参考个体多于 20 例,在参考区间之外的数据不超过 10%为通过验证;若超过 10%的数据在参考区间之外,则另选至少 20 例合格参考个体,重新按照上述判断标准进行验证。参考区间验证通过,实验室可使用本标准参考区间。
验证方法:依据WS/ T 404-2012《临床常用生化检验项目参考区间》进行检测项目生物参考区间验证,选取表观正常人群(男、女或不分性别)20例新鲜样本,进行一次性测定,统计结果分析20例测定结果是否在实验室采纳的正常参考范围区间内。在20例测试对象的数据中,如果有不超过2个数值(95%参考限--测试结果的10%)落在科室采纳的参考范围界限以外,那么接受实验室采纳的参考范围。
以雅培 Alinity TT4 项目为例:
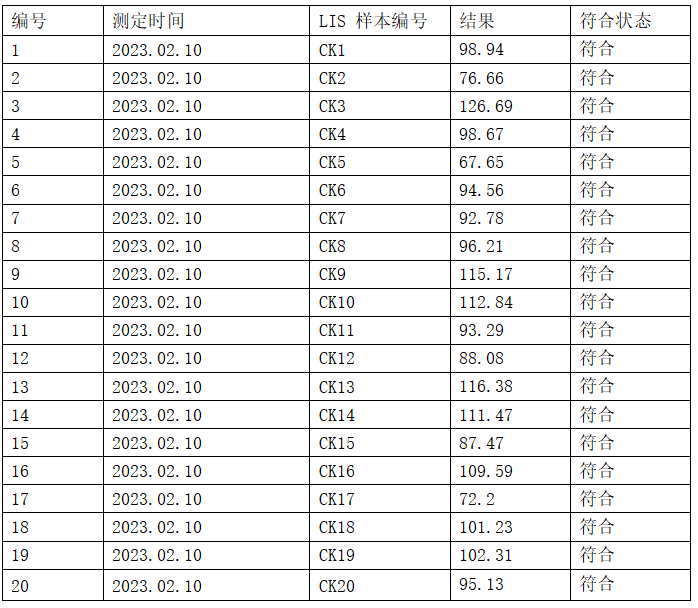
结论:TT4参考区间符合要求
评价内容五:临床可报告范围(高限)
定量分析方法的可报告范围是临床实验室发出检验报告的依据之一,可报告范围的验证包括可报告低限(定量下限)与可报告高限(定量上限×样本最大稀释倍数)。
可报告范围低限(定量下限) :以方法性能标示的总误差或不确定度为可接受界值,从低值样本结果数据中选取总误差或不确定度等于或小于预期值的最低浓度水平作为可报告范围低限。
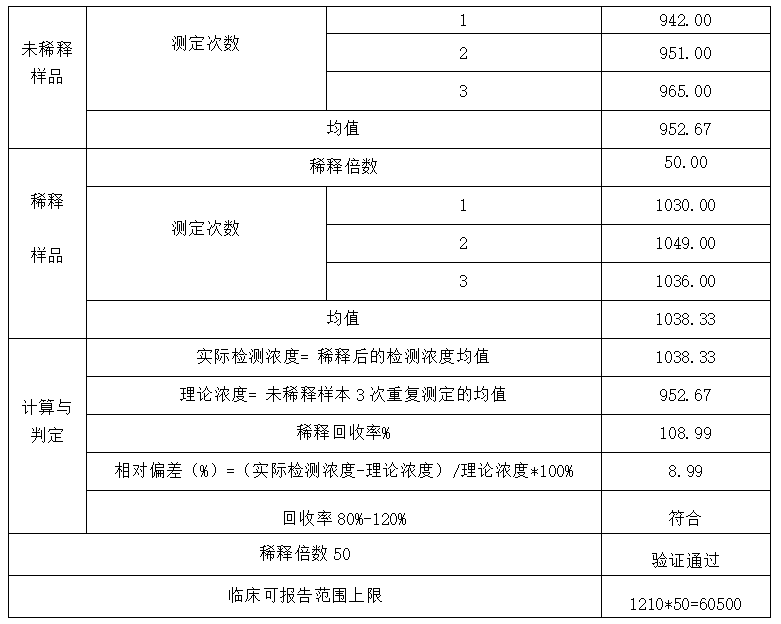
可报告范围高限 :选取还原浓度与理论浓度的偏差(%)等于或小于方法预期偏倚值时的最大稀释倍数为方法推荐的最大稀释倍数,测量区间的高限与最大稀释倍数的乘积为该方法可报告范围的高限。对于厂家宣称的推荐稀释倍数,实验室需要进行验证。
方案:参照CNAS-GL037《临床化学定量检验程序性能验证指南》进行检测项目临床可报告范围评价,收集较高浓度的样品(浓度为稀释后位于检测范围的上1/3),未稀释样品重复测定3次;稀释样品重复测定3次。对高值样本,计算乘以稀释倍数后的还原浓度和相对偏差。
以罗氏 Cobas e801 AFP项目为例,推荐使用1:50的稀释比例
评价内容六:定量检出限 (LOQ)
以下方案适用于基于TE准确度目标的LOQ声明验证,仅基于精密度目标的LOQ声明验证可通过CLSI EP15中精密度试验进行验证。
方案要求
最简单的试验设计应包括:
a)一个试剂批号;
b) 一个仪器系统;
c) 3天实验;
d)2个LoQ声明浓度附近的标本:
e) 每天每个标本重复测量2次;
f)总计 20 个低值重复检测结果。
数据分析方式如下:
a)保证检测结束时有足够的测量结果进行数据分析。至少应包括 20个标本结果:
b)对每个标本计算靶值士允许 TE:
c)计算每个标本落在允许总误差范围内的检测结果个数,然后计算所有标本检测结果满足 LoQ声明的可接受标准的比例;
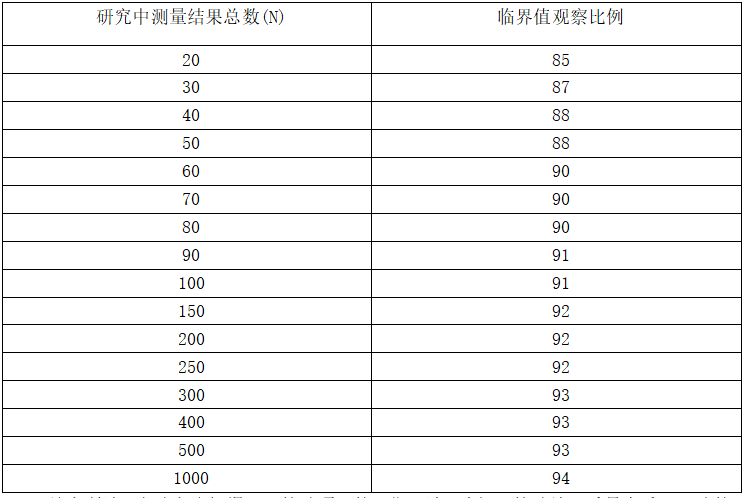
d)将得到的百分比与附录E的临界值比较,如果没有匹配的测量结果总数(N),选择最接近的值;
e)如果观察百分比大于或等于附录E中的值,则验证成功;
f)如果观察百分比小于附录E中的值,则验证失败。查找原因。如有必要,咨询测量程序建立者,根据验证结果,执行新的验证研究或利用评价方案确立 LoQ 声明。
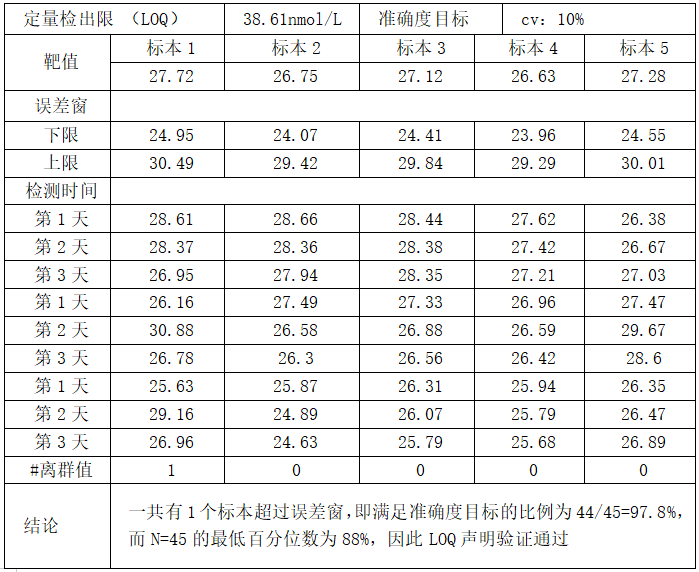
验证方案:LOQ(依据WS/T 514-2017):准备5份浓度低于定量限声明的样本,每天、每个样本复测3 次,检测3天,获得45个检测结果。用已知的准确度可接受的测量程序得到这5个标本的靶值,分别计算其允许不精密度范围。将每个标本的结果与允许不精密度范围进行比较。如果45个结果中40个以上结果(含40)落在样本靶值±10%cv以内则验证通过。
以雅培 Alinity TT4 项目为例:
评价内容七:检出限 (LoD)
方案要求
最简单的试验设计应包括:
a)一个试剂批号;
b)一个仪器系统;
c)3天实验;
d)2个LoD声明浓度附近的标本;
e)每天每个标本重复测量2次;
f)总计20个低值重复检测结果。
数据分析方式如下:
a)保证检测结束时有足够的测量结果进行数据分析,至少应包括 20个低值标本结果;
b)计算低值测量结果等于或超过LoD声明的百分比:
c)将得到的百分比与附录E的临界值比较,如果没有匹配的测量结果总数(N),选择最接近的值;
d) 如果观察百分比大于或等于附录E中的值,则验证成功;
e)如果观察百分比小于附录E中的值,则验证失败,查找原因。如有必要,咨询测量程序建立者,根据验证结果,执行新的验证研究或利用评价方案确立 LoD 声明。
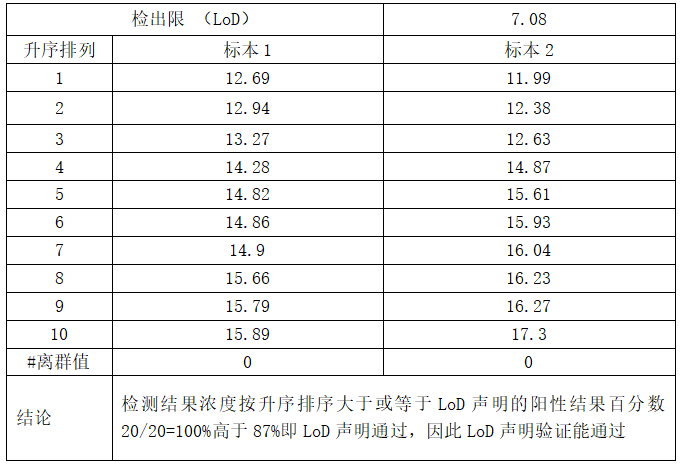
验证方案:验证方案:LoD(依据WS/T 514-2017):连续3d检测对2个低值患者样本重复检测4次,所有数据来源于1个仪器系统和1个批号试剂。检测结果浓度按升序排序大于或等于LoD声明的阳性结果百分数高于87%即LoD声明通过.
以雅培 Alinity TT4 项目为例:
附表:测量结果总数与临界值观察比例对照表
**
表 E.1测量结果总数与临界值观察比例对照表
综上所述,实验室应根据不同检验项目的预期用途,选择对检验结果质量有重要影响的参数进行验证。如果性能指标的验证结果不符合实验室制定的判断标准,应分析原因,纠正后再实施验证。如果验证结果符合制造商或研发者声明的性能指标,但不满足实验室制定的判断标准,结果不可接受。
作者:陶春妃 成都市第三人民医院检验科
编辑:熊熊
**


