一例钠-氯比例失衡的低氯血症分析
前言
Cl-是细胞外液最重要的阴离子,约占总阴离子含量的70%,对机体体液调节、维持酸碱平衡、电解质平衡、细胞内外渗透压、水分布以及肌肉活动等方面起着重要作用。人们通常认为Cl-是与Na+浓度相关的被动阴离子,为了保持电中性,Cl-或HCO3-等阴离子须与Na+同向变化,以维持体液的渗透性和酸碱度平衡。长期以来,人们更多关注的是Na+在疾病中的作用,而对Cl-有所忽视。本文试图对一例钠-氯比例严重失衡的低氯血症进行分析。
病例信息
患者女,66岁,2022年6月13日因腹痛入院,腹部CT显示:肠系膜上动脉血栓形成,小肠多发小液平,盆腔少许积液,诊断“肠系膜上动脉血栓”,行开腹坏死小肠切除+盲肠切除+小肠造口术,术后予抗炎、止痛及保护胃黏膜等对症治疗后好转出院。于6月底前后开始直至本次入院(2022年7月11日),持续出现恶心、呕吐,多发生于进饮食后,非喷射样,呕吐物为胃内容物,伴有嗳气。自觉反酸、烧心,自诉食欲减退,食纳差,仅进少量流食,无腹痛、腹胀,乏力明显,不能进行日常活动。
本次发病以来感头晕,无头痛,无发热寒战,无咳嗽咯痰,无胸闷气短,无胸痛、心悸,食纳极差,夜休差,小便未见明显异常,大便于造瘘口排出,每日更换造瘘袋2次。患者既往高血压病史10余年,血压最高160/90mmHg,长期口服“吲达帕胺”控制血压;冠心病及心房颤动病史6年,长期口服“单硝酸异山梨酯片”,否认糖尿病史、无传染病史。本次入院后多次实验室检查可见:电解质指标呈现低钠、低氯;且多次出现钠-氯比例严重失衡;肾功指标异常;血气分析呈现持续代谢性碱中毒状态。见表。本次住院期间,多次使用呋塞米,剂量为20mg/d。
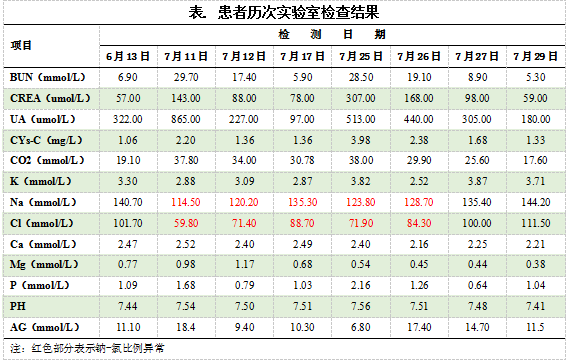
案例分析
该患者首次入院时电解质、酸碱稳态和肾功大致正常,胃肠道术后出院后出现较长时间的电解质、酸碱稳态和肾功异常。我们对其中的低氯血症且钠-氯比例严重失衡的病理生理变化过程分析如下:
1、呕吐导致胃液丢失,发生低氯血症和代谢性碱中毒:
胃液的主要成分是HCL,由壁细胞分泌。胃液中的H+浓度比血液中的高三、四百万倍。合成HCL的H+逆浓度梯度被分泌膜上的H+泵泵入分泌小管;而Cl-来自血浆,Cl-一方面顺着浓度差从血液弥散入壁细胞内,另一方面还通过Cl--HCO3-逆向转运体进入壁细胞内,再依靠细胞内小管膜上的Cl-泵,主动转运入小管内。H+和Cl-在细胞内小管中形成HCl,然后被分泌入胃腔。该患者连续几天呕吐导致胃液丢失,进而发生低氯血症和代谢性碱中毒。这是导致本次诸多异常的最初始原因。
2、该患者同时存在Cl-消化道吸收不足和消化道排出增多:
正常情况下,Cl-的来源主要是靠饮食摄入,在食物的整个消化过程中几乎都可以对Cl-进行吸收,约98%的膳食氯会被吸收。每天通过粪便排泄的氯化物大约为10-15mmol/L,而如果吸收不良,每天则有超过90 mmol/L的氯化物可能会被消化道排出[1]。该患者胃肠道功能明显异常,食纳极差,导致原本就很有限的膳食氯还未能被充分吸收。
3、代谢性碱中毒导致/加重低氯血症:
Cl-耗竭可导致代谢性碱中毒,代谢性碱中毒又会频繁发生低氯血症。这是因为血清K+、Na+、Cl-、H+和HCO3-之间存在着复杂的相互依赖关系。组织细胞内液是机体酸碱平衡的缓冲池,细胞的缓冲作用首先通过细胞膜上的离子交换而实现。几乎所有的细胞膜内外均可进行H+-K+、H+-Na+、Na+-K+、Cl--HCO3-的双向离子交换以维持电中性。我们大家都比较熟悉的酸中毒时往往伴有高钾血症而碱中毒时伴有低钾血症即是由于这一机制。但Cl--HCO3-的交换也很重要,因为Cl-是可以自由交换的的阴离子,当HCO3-升高时,HCO3-的排泄只能由Cl--HCO3-交换来完成,特别是红细胞的Cl--HCO3-交换对急性呼吸性酸碱紊乱的调节起重要作用[2]。在碱中毒时,通过细胞膜的离子交换,虽然减轻了细胞外液的酸碱度变化,但可引起继发性的低氯血症。在该病例中,由于较长时间维持碱中毒状态,红细胞,肌细胞和骨组织细胞均通过Cl--HCO3-交换来进行代偿,而钠离子的交换相对要少,因此,这将导致更低的Cl-水平。这可能是钠-氯比例失衡的原因之一。
4、肾脏对Cl-的重吸收能力下降,Cl-经尿液排出增多:
正常情况下Cl-排出主要通过肾脏,在肾脏中约99%的Cl-被重吸收,其中约有70%-在近端小管被重吸收,约20%在髓袢被重吸收,另有约10%在远曲小管和集合管被重吸收,仅有约1%从尿中排出体外。尿液中的Cl-浓度由肾小球过滤的量和沿肾单位的吸收和分泌平衡调节,通常范围在110-250 mmol/L之间,普通人群尿液氯化物的排泄量大致等于摄入量[3]。Cl-还是肾小管-肾小球反馈的主要调节剂,并且肾素的分泌、管球反馈及一些利尿剂敏感的Na+通道的调节主要取决于Cl-[4,5]。
肾脏因素导致血清Cl-浓度降低有稀释性和消耗性低氯血症两种。稀释性低氯血症是由于精氨酸加压素释放增加以及血管紧张素Ⅱ激活的增加造成水在体内的潴留,导致稀释性低氯血症[3];而消耗性低氯血症是由于髓袢升支粗段和远曲小管中对电解质重吸收功能受到抑制,从而促进Cl-的排泄所致[6]。当发生代谢性碱中毒时,为保持阴离子平衡,肾脏代偿性的对Cl-重吸收减弱,导致血液Cl-下降明显。研究表明,袢利尿剂可使氯化物的排泄量增加[7]。该患者持续存在碱中毒状态,Cl-从细胞外进入细胞内,肾小管对Cl-重吸收减弱,使用利尿剂呋塞米导致Cl-经肾脏排出增多,因此应为消耗性的低氯血症。这可能也是钠-氯比例失衡的原因之一。
5、利尿剂与低氯血症:
呋塞米(速尿)是临床常用的利尿剂,属于袢利尿剂,主要抑制髓袢升支髓质和皮质对Cl-和Na+的重吸收,促进Cl-、Na+、K+和水分的大量排出。研究显示,袢利尿剂可使氯化物的排泄量增加20倍[7]。与Na+和K+排泄相比,应用袢利尿剂时,Cl-会额外损失10%-20%,而此时受影响的Na-K-2Cl泵却仍可能重吸收Na+[8]。已有报道称应用利尿剂可出现Na+水平正常的低氯血症[9]。该患者静脉注射呋塞米的剂量为20 mg/d,使用时间与钠-氯比例严重失衡时间完全一致,因此,呋塞米的使用也可能是导致低氯低钠且钠-氯比例严重失衡的原因之一。
综上所述,该患者术后胃肠功能异常,食纳极差,Cl-摄入不足;吸收不良导致本就有限的膳食Cl-大都经粪便排出;呕吐导致Cl-经上消化道丢失增多;以上因素共同导致消耗性低氯血症。而胃液丢失过多又导致低氯性代谢性碱中毒。机体在对碱中毒进行代偿时,Cl-从细胞外转移至细胞内增多,肾脏对Cl-重吸收减弱,兼之利尿剂的使用可使更多的Cl-被排出。在上述这些过程中,Na+受到的影响都相对较小,因此出现了钠-氯比例严重失衡的低氯血症。
+
病例信息
这是一例由于原发疾病导致的电解质及酸碱平衡紊乱的病例,Cl-只是其中变化的一部分。通过该病例,有助于我们充分认识酸碱紊乱和电解质紊乱的病理生理过程,也有助于我们更加深入的认识Cl-在机体中的生理作用和价值。我们通常认为,Cl-是与Na+浓度有关的被动阴离子。
但近年来研究发现,与Na+不同,Cl-在体内平衡中具有独特的作用。研究发现:
(1)一些神经激素的盐感应激活和生理反馈依赖于Cl-而不是Na+[10]。
(2)低氯血症是心力衰竭患者不良预后的独立预测因素[9],在心力衰竭患者当中,Na+浓度只可以解释不到30%的Cl-浓度的变化[8],且将Cl-纳入心力衰竭患者预后模型后,Na+的预后作用将消失[11]。
(3)钠-葡萄糖协同转运蛋白2抑制剂似乎可以维持或增加血清Cl-水平,降低HCO3-的水平,而血清Na+和K+水平可维持不变[12]。这些都提示在机体的病理生理过程中,Cl-可能起到了更为重要且独特的作用,而不仅仅只是作为Na+的辅助离子来维持电荷平衡。
还有报道称血清Na+与Cl-的比值和尿中的Cl-浓度测定有助于区分消耗性和稀释性低氯血症[9,13],但目前相关研究仍然较少。本文中所谓的钠-氯比例严重失衡也只是基于长期的工作经验而形成的一种主观印象,还缺乏明确的判断标准和依据。这都可能为我们以后的研究提供方向和思路。
参考文献
[1] Arietje J.L. Zandijk, Margje R. van Norel, Florine E.C. Julius, et al. Chloride in Heart Failure-The Neglected Electrolyte[J]. J Am Coll Cardiol HF. Oct 06, 2021. Epublished DOI: 10.1016/j.jchf.2021.07.006.
[2] 李桂源.病理生理学[M].北京:人民卫生出版社,2010:161.
[3] Verbrugge FH, Steels P, Grieten I, et a1. Hyponatremia in acute decompensated heart failure:deplenon versus dilution[J]. J Am Co¨Cardiol,2015,65(5):480-492.DOI:10.1016/j.jacc.2014.12.010.
[4] 刘洪泽,崔丽,曹月娟. 低氯血症与心力衰竭的研究进展[J].中华老年心脑血管病杂志,2019,21(9):995-997.DOI:10. 3969/ j. issn. 1009-0126. 2019. 09. 026.
[5] O’Connor CM, Ahmad T. The Role of Sodium and Chloride In Heart Failure: Does It Take Two to Tango ? [J] .J Am Coll Cardiol, 2015,66 ( 6 ):667-669.DOI:10. 1016/j. jacc. 2015. 05. 070.
[6] Elfar A, Sambandam KK. The basic metabolic profile in heart failure—marker and modifier[J]. Curr Heart Fail Rep. 2017;14(4):311–320.
[7] Kataoka H. Dynamic changes in serum chloride concentrations during worsening of heart failure and its recovery following conventional diuretic therapy: A single-center study[J].Health Sci Rep,2018,1(11):e94.DOI:10. 1002/ hsr2. 94.
[8] Testani JM, Hanberg JS, Arroyo JP, et al.Hypochloraemia is strongly and independently associated with mortality in patients with chronic heart failure[J]. Eur J Heart Fail. 2016;18(6):660–668.
[9] Cuthbert JJ, Pellicori P, Rigby A, et al. Low serum chloride in patients with chronic heart failure: clinical associations and prognostic significance[J]. Eur J Heart Fail. 2018;20(10):1426–1435.
[10] Hanberg JS, Rao V, Ter Maaten JM, et al.Hypochloremia and diuretic resistance in heart failure: mechanistic insights[J]. Circ Heart Fail.2016;9(8):e003180.
[11] Armstrong PW, Pieske B, Anstrom KJ,et al, VICTORIA Study Group. Vericiguat in patients with heart failure and reduced ejection fraction[J]. N Engl J Med. 2020;382(20):1883–1893.
[12] Kataoka H, Yoshida Y. Enhancement of the serum chloride concentration by administration of sodium-glucose cotransporter-2 inhibitor and its mechanisms and clinical significance in type 2 diabetic patients: a pilot study[J]. Diabetol Metab Syndr. 2020;12:5.
[13] Grodin JL, Sun JL, Anstrom KJ, et al. Implications of serum chloride homeostasis in acute heart failure (from ROSE-AHF)[J]. Am J Cardiol.2017;119(1):78–83.
作者:刘栋,齐虎,李香玉 铜川市人民医院检验科
编辑:伟


